Oleh: Dr. M. Sonny Abfertiawan, S.T., M.T. (GES Environmental Engineer)
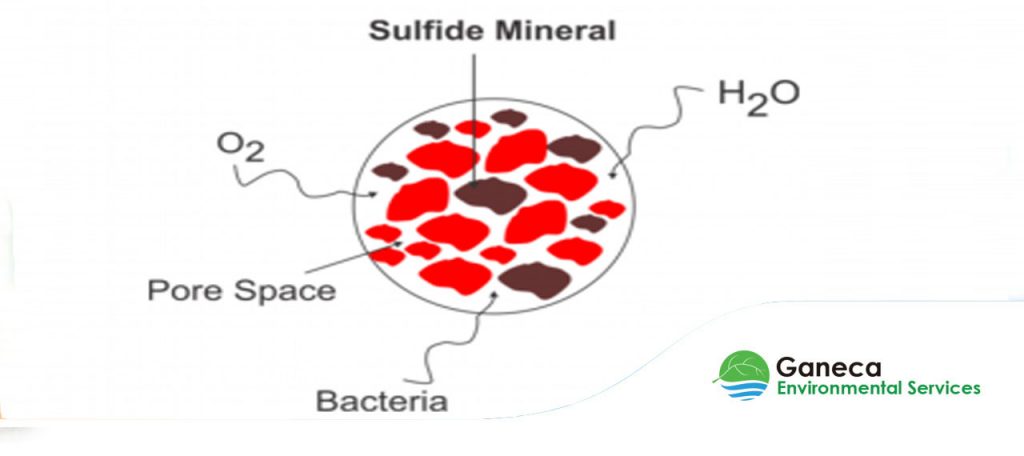
Air Asam Tambang merupakan salah satu isu lingkungan yang berpotensi terjadi di kegiatan penambangan baik batubara maupun bijih. Air asam tambang terbentuk karena adanya mineral sulfida yang tersingkap akibat kegiatan penggalian dan penimbunan batuan penutup. Mineral sulfida tersebut kontak dan teroksidasi oleh oksidator utama yakni oksigen dan membentuk produk-produk oksidasi. Produk-produk oksidasi tersebut kemudian terlindi oleh adanya air (air hujan). Hal ini menyebabkan peningkatan keasaman di badan air penerima yang ditandai dengan rendahnya nilai pH. Selain peningkatan keasaman, pembentukan air asam tambang juga menyebabkan peningkatan terhadap konsentrasi logam-logam terlarut di badan air penerima.
Di pertambangan batubara yang menerapkan metode tambang terbuka (open pit mine), air asam tambang berpotensi terbentuk di dua lokasi yakni pit penambangan (mine pit) dan timbunan batuan penutup (overburden disposal). Pembentukan air asam tambang di pit penambangan tidak dapat dihindari ketika lapisan batuan penutup yang berpotensi membentuk air asam tambang tersingkap menjadi dinding pit dan kontak dengan oksigen dan air. Oleh karena itu, air asam tambang yang bersumber dari pit penambangan berpotensi memiliki kualitas yang tidak memenuhi baku mutu lingkungan sehingga harus dialirkan ke sistem pengolahan air asam tambang sebelum masuk ke badan air penerima. Sedangkan pembentukan air asam tambang di timbunan batuan penutup berpotensi dapat terbentuk ketika timbunan tersebut belum final dan jika tidak adanya upaya pencegahan pembentukan air asam tambang yang salah satunya dapat dilakukan melalui metode enkapsulasi material PAF dengan menggunakan NAF.
Mineral sulfida merupakan mineral yang secara alami berdasarkan proses pembentukannya sudah terkandung didalam batuan. Mineral yang menjadi sumber pembentuk air asam tambang ini berpotensi dapat ditemukan di area penambangan baik tambang batubara maupun mineral (emas, lead, zinc, dll). Terdapat beberapa jenis mineral yang menyebabkan terbentuknya air asam tambang. Perhatikan berikut ini.
Tabel 1 Mineral sulfida yang diketahui sebagai pembentuk Air Asam Tambang
| Mineral | Formula |
| Sulfida yang menghasilkan AAT dengan oksigen sebagai oksidan: | |
| Pyrite, marcasite | FeS2 |
| Pyrrhotite | Fe1-xS |
| Bornite | Cu5FeS4 |
| Arsenopyrite | FeAsS |
| Enargite/famatinite | Cu3AsS4/Cu3SbS4 |
| Tennantite/tetrahedrite | (Cu,Fe,Zn)12As4S13/(Cu,Fe,Zn)12Sb4S13 |
| Realgar | AsS |
| Orpiment | As2S3 |
| Stibnite | Sb2S3 |
| Tambahan sulfida yang dapat menghasilkan Air Asam Tambang dengan oksidan besi ferri: | |
| Sphalerite | ZnS |
| Galena | PbS |
| Chalcopyrite | CuFeS2 |
| Covellite | CuS |
| Cinnabar | HgS |
| Millerite | NiS |
| Pentlandite | (Fe,Ni)9S8 |
| Greenockite | CdS |
Mineral sulfida tersebut akan teroksidasi oleh kehadiran oksigen ketika adanya aktivitas penggalian dan penimbunan di pertambangan. Oksidasi minerasl sulfida dan adanya air akan membentuk produk oksidasi berupa besi fero, sulfat dan asam. Reaksi pembentukan air asam tambang dapat terjadi berdasarkan tahapan reaksi sebagai berikut:
Oksidasi Mineral Sulfida (Pyrite) oleh kehadiran Oksigen
2FeS2(s) + 15O2(g) + 2H2O(l) -> 2Fe2+(aq) + 4SO42-(aq) + 4H+(aq)
Pirit + Oksigen + Air -> Besi Ferro + Sulfat + Keasaman
Pyrite merupakan salah satu mineral sulfida utama yang sering ditemukan di area pertambangan terutama tambang batubara. Ketika kegiatan penggalian dan penimbunan dilakukan, mineral pyrite yang terkandung di dalam batuan penutup (overburden) maupun interburden tersingkap ke udara terbuka. Hal ini menyebabkan pyrite teroksidasi oleh oksigen bebas dan terlindi oleh air (hujan). Hasil reaksi tersebut membentuk besi ferro, sulfat, dan keasaman H+ yang menyebabkan penurunan nilai pH air.
Oksidasi Besi Ferro menjadi Besi Ferri oleh kehadiran Oksigen
4Fe2+(aq) + O2(g) + 4H+(aq) -> 4Fe3+(aq) + 2H2O(l)
Besi Ferro + Oksigen + Keasaman -> Besi Ferri + Air
Pada tahapan selanjutnya, besi ferro yang dihasilkan pada reaksi pertama dioksidasi oleh oksigen pada kondisi yang asam membentuk besi ferri. Reaksi ini berjalan cukup lambat namun keberadaan bakteri acidophiles yang berperan sebagai katalisator menyebabkan reaksi menjadi lebih cepat.
Hidrolisa Besi Ferri
4Fe3+(aq) + 12 H2O(l) -> 4Fe(OH)3(s) + 12H+(aq)
Besi Feri + Air -> Besi Hidroksida + Keasaman
Hidrolisa adalah reaksi yang pemisahan molekul air. Besi ferri terhidrolisa membentuk besi hidroksida dan 12 mol keasaman. Proses reaksi ini lebih banyak terjadi pada lingkungan air dengan pH di atas 3,5. Reaksi ini menyebabkan terbentuknya presipitat besi hidroksida yang berwarna kuning keemasan yang sering dikenal dengan istilah “yellowboy”.
Reaksi Lanjutan: Oksidasi Pyrite oleh Oksidan Besi Ferri
FeS2 (aq) + 14Fe3+(aq) + 8H2O(l) -> 15Fe3+(aq) + 2SO42-(aq) + 16 H+(aq)
Pirit + Besi Feri + Air -> Besi Fero + Sulfat + Keasaman (16 mol)

Reaksi ini merupakan reaksi lanjutan ketika lingkungan air terpenuhi. Besi ferri dapat berperan menjadi oksidan kuat pada kondisi lingkungan air yang sangat asam (pH<3). Reaksi ini merupakan reaksi propagasi (perbanyakan) yang berlangsung sangat cepat dan akan berhenti ketika mineral sulfida pyrite dan atau besi ferri telah habis. Reaksi lanjutan ini merupakan reaksi yang menghasilkan nilai keasaman lebih besar jika dibandingkan dengan reaksi lainnya. Keasaman yang dihasilkan dalam reaksi ini mencapai 16 mol H+.
Referensi:
Abfertiawan, M.S. Model Transpor Air Asam Tambang Melalui Pendekatan Daerah Tangkapan Air. 2016. Disertasi Doktor. Institut Teknologi Bandung. Bandung
Ditulis Oleh: Muhammad Sonny Abfertiawan